Wyrób medyczny i Norma PN-EN ISO 13485
Wyrób medyczny i konieczność wdrożenia Normy PN-EN ISO 13485 : 2016 w kontekście Rozporządzenia MDR i klas wyrobów medycznych.
Wyrób medyczny i konieczność wdrożenia Normy PN-EN ISO 13485 : 2016 w kontekście Rozporządzenia MDR i klas wyrobów medycznych.
Wszystkim naszym obecnym i potencjalnym Klientom życzymy zdrowych, udanych i rodzinnych Świąt Wielkanocnych.
Niech na stołach zagoszczą szynki, mazurki ozdobione migdałami i koszyczki napełnione pisankami !
A po świętach zapraszamy do wdrożeń różnorodnych norm z serii EN-PN ISO.
W marcu kontynuujemy wdrożenia norm ISO. Szczególnym zainteresowaniem cieszy się norma ISO 13485:2016 dla wyrobów medycznych.
A przy okazji panowie z ISO SYSTEM Sp. z o.o. składają najlepsze życznia wszystkim Paniom z okazji 8 marca.
Pragniemy złożyć Państwu najserdeczniejsze życzenia
Zdrowych i Spokojnych Świąt Bożego Narodzenia
oraz wszelkiej pomyślności w nadchodzącym Nowym Roku 2023!

W IV kwartale 20022 roku koncentrujemy się na kolejnych wdrożeniach normy ISO 13485 dla wyrobów medycznych (oprogramowanie).
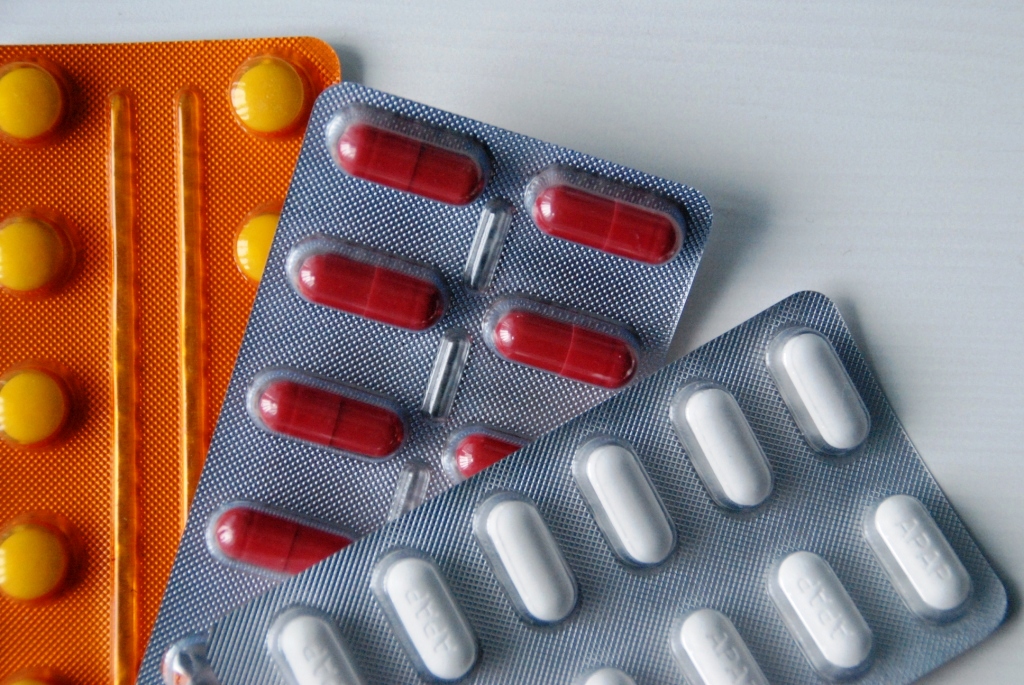
Po wakacjach kontynuujemy projekty wdrożeniowe w Poznaniiu i w całym kraju. Nasi konsultanci pozostają do Państwa dyspozycji w zakresie wdrożeń norm ISO, ze szczególnym uwzględnieniem: ISO 9001, ISO 14000 oraz ISO 13485.

Norma ISO 13485 została wydana już w roku 2005, ale ostatnia nowelizacja pochodzi z roku 2016. Po siedemnastu latach funkcjonowania nadal cieszy się zainteresowaniem polskich podmiotów, zajmujących się produkcją lub wprowadzaniem na rynek wyrobów medycznych. Wdrożenie normy ISO 13485 umożliwia organizacji dostosowanie swojego systemu zarządzania jakością do przepisów dotyczących wyrobów medycznych. Wymagania te dotyczą wszystkich organizacji dostarczających wyroby medyczne, bez względu na rodzaj i wielkość podmiotu. Metodyka wdrażania normy ISO 13485:2016 jest pochodną normy ISO 9001, ze szczególnym uwzględnieniem zadowolenia klienta i ciągłego doskonalenia. Należy jednocześnie mieć na uwadze, że posiadanie certyfikatu ISO 9001 nie zapewnia zgodności z normą ISO 13485, chociaż znacznie przyspiesza jej wdrożenie.
W związku z tym organizacje, które wdrożyły już normy z serii ISO 9000, mogą liczyć na naszą specjalną ofertę cenową w sytuacji potrzeby "rozszerzenia" certyfikacji o normę ISO 13485. Szczegółowe informacje:
Zapraszamy do kontaktu z nami z użyciem formularza, albo telefonicznie >>

Uprzejmie informujemy, że nasze biuro w wakacje pracuje w niezmienionym trybie. Zapraszamy do odwiedzin albo kontaktu telefonicznego lub mailowego i życzymy udanego, letniego wypoczynku!
Zapraszamy do kontaktu z nami z użyciem formularza, albo telefonicznie >>
